通常在ECMO(体外膜肺氧合)等循环支持装置中需要限制剪切应力阈值以避免高剪切力下的溶血。然而,在ECMO临床治疗中溶血现象仍时常发生,其原因一直未明。为此,清华大学机械系微流体课题组博士研究生潘云帆以及指导教师李永健、陈皓生利用微流控技术开展了深入研究,在国际顶级跨学科学术期刊 《美国科学院院刊》(PNAS)上发表了题为“ECMO治疗过程中的红细胞疲劳”(Fatigue of red blood cells under periodic squeezes in ECMO)的论文,该论文近日荣获了中国医师协会体外生命支持学会2022年度“最佳论文奖”。

中国医师协会体外生命支持学会“最佳论文奖”
在该研究中,研究者首先在体外膜肺氧合患者临床血液标本中观察到除了正常双凹形态的红细胞以外,还存在棘形和球形的异常形态红细胞,且随着治疗时间的增加,异常红细胞在血液中的比例逐渐上升,同时病人出现了游离血红蛋白浓度缓慢升高的溶血现象。研究者通过专门设计的微流控芯片装置模拟了体外膜肺氧合中循环挤压红细胞的过程,并通过高速相机捕获到了红细胞的形态变化,发现红细胞疲劳过程分为双凹、棘形、球形和破裂溶血四个阶段。并且,随着其形态变化,红细胞的杨氏模量增加,变形能力降低,呈现疲劳累积现象,并最终出现溶血。

图1 红细胞疲劳过程的典型形态(a)正常双凹红细胞(b)棘形红细胞(c)球形红细胞
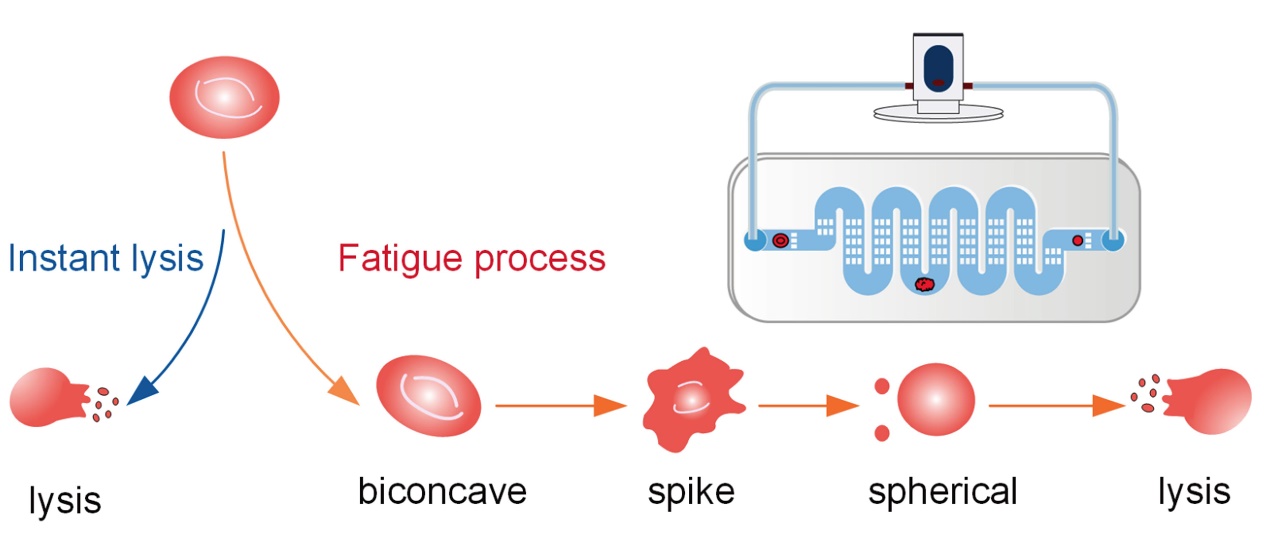
图2 红细胞的疲劳示意图
研究团队进一步发现这种疲劳导致溶血的机制主要取决于红细胞在周期性剪切作用下的ATP释放和恢复速度。红细胞在每次挤压下的变形和恢复都伴随着三磷酸腺苷(ATP)的释放和恢复。当ATP释放量大于恢复量时,ATP的消耗导致细胞膜和细胞骨架之间的带3-锚蛋白键解离,红细胞发生形态改变并逐渐失去变形能力,随后红细胞发生溶血。
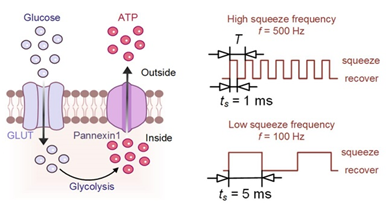
图3 红细胞疲劳的生理机制
该研究揭示了红细胞在低应力高频率挤压诱导下疲劳溶血的生理机制,对于深入理解溶血现象,以及改进血泵、人工瓣膜等植介入器械的设计具有重要作用。
中国医师协会体外生命支持专业委员会(CSECLS) 是体外生命支持领域的前沿专家团体,长期致力于提高全国体外生命支持技术水平,加强国际交流合作,推动体外生命支持技术的基础研究与临床运用。中国医师协会体外生命支持学会 “最佳论文奖”每年评选一次,每次在全国范围内遴选出本领域三篇最佳论文。
论文链接:https://doi.org/10.1073/pnas.2210819119