由于“肿瘤-免疫循环”(Cancer-Immunity Cycle; CIC)的高度复杂性和异质性,导致对免疫疗法的总体反应率有限。免疫治疗抵抗或无效的机制可分为以下几类。其一,局部“肿瘤微环境”(Tumor Microenvironment; TME)和全身免疫反应的免疫抑制环境可能导致驻留或浸润的细胞毒性免疫细胞失活或衰竭,如“细胞毒性T淋巴细胞”(Cytotoxic T Lymphocyte; CTL)。其次,局部TME的变形结构和血管高渗渗漏对治疗性细胞浸润或药剂输送构成了物理屏障。三,由于TME和系统免疫反应的异质性,治疗性基因改造细胞上的特定分子结构总是导致反应的可变性和免疫抵抗。例如,实体瘤含有携带逃逸变体的细胞,可以逃避“嵌合抗原受体T细胞”(Chimeric Antigen Receptor T cell; CAR T cell)的定位。第四,有限的或不适当的给药方案导致疗效下降和过量的副作用增加。然而,解决所有这些挑战是传统的肿瘤模型系统,即二维共培养和动物模型所不能及的。
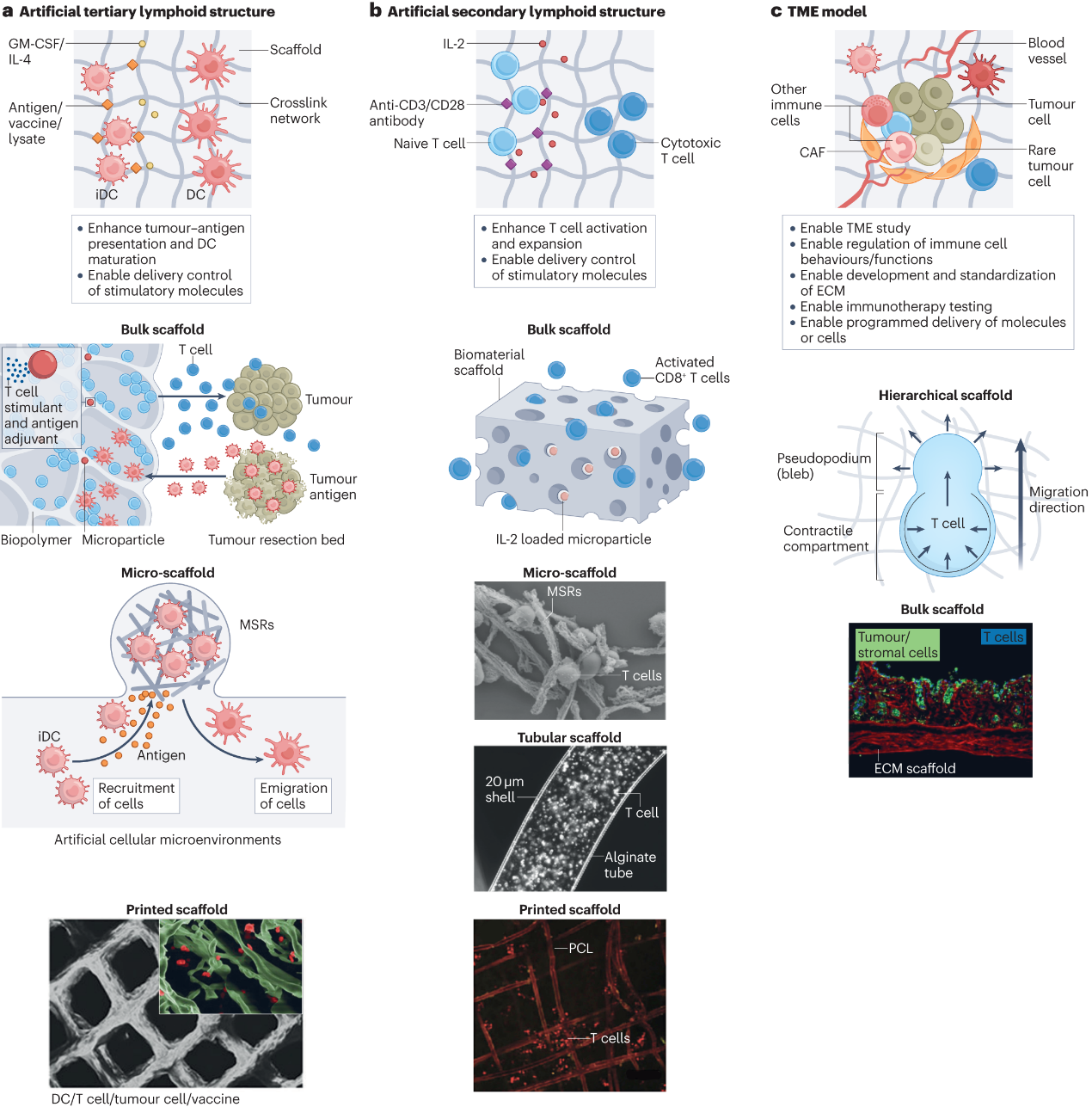
图1:用于肿瘤免疫学研究的基于支架的三维模型示意图
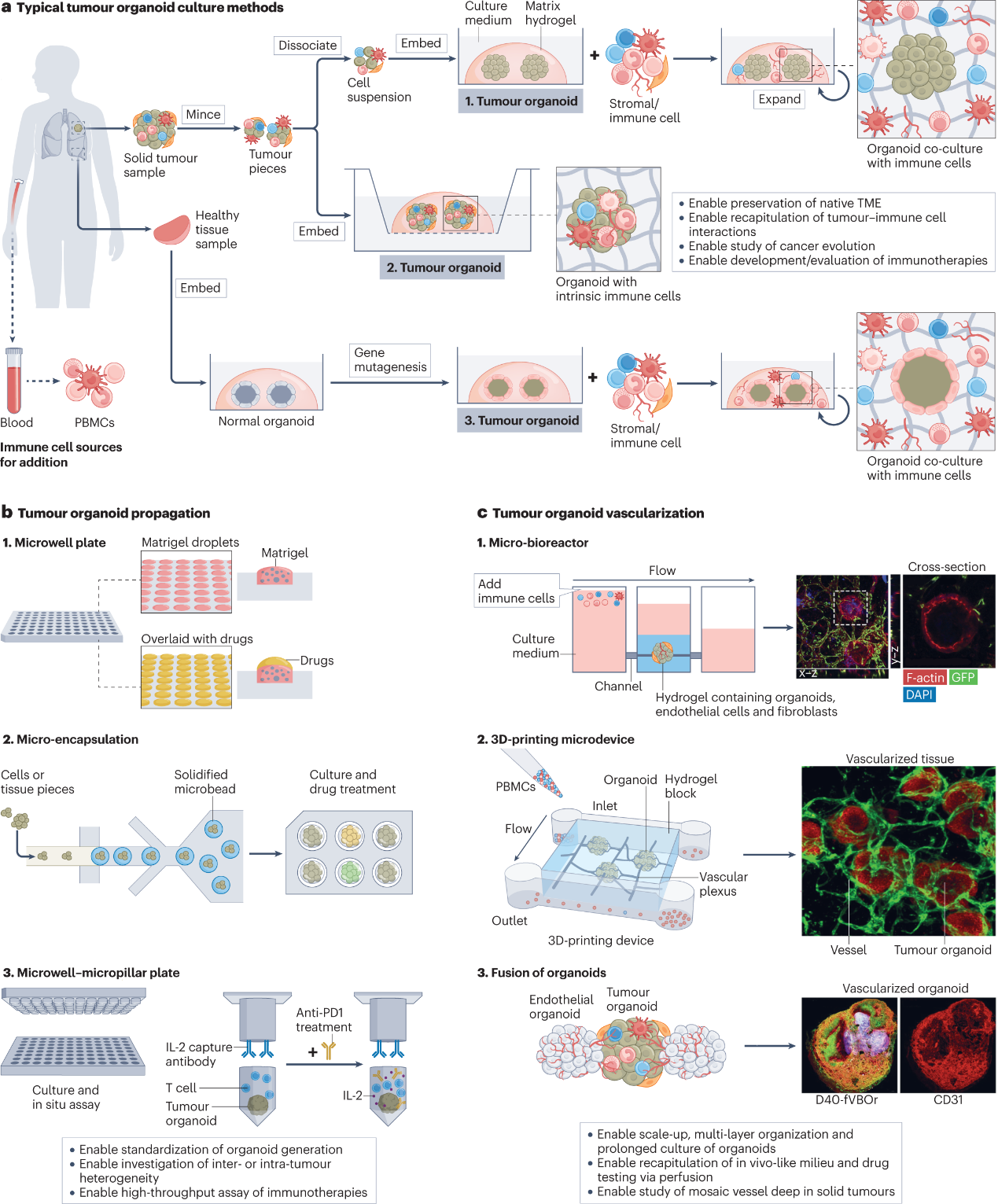
图2:用于肿瘤免疫学研究的肿瘤类器官模型示意图
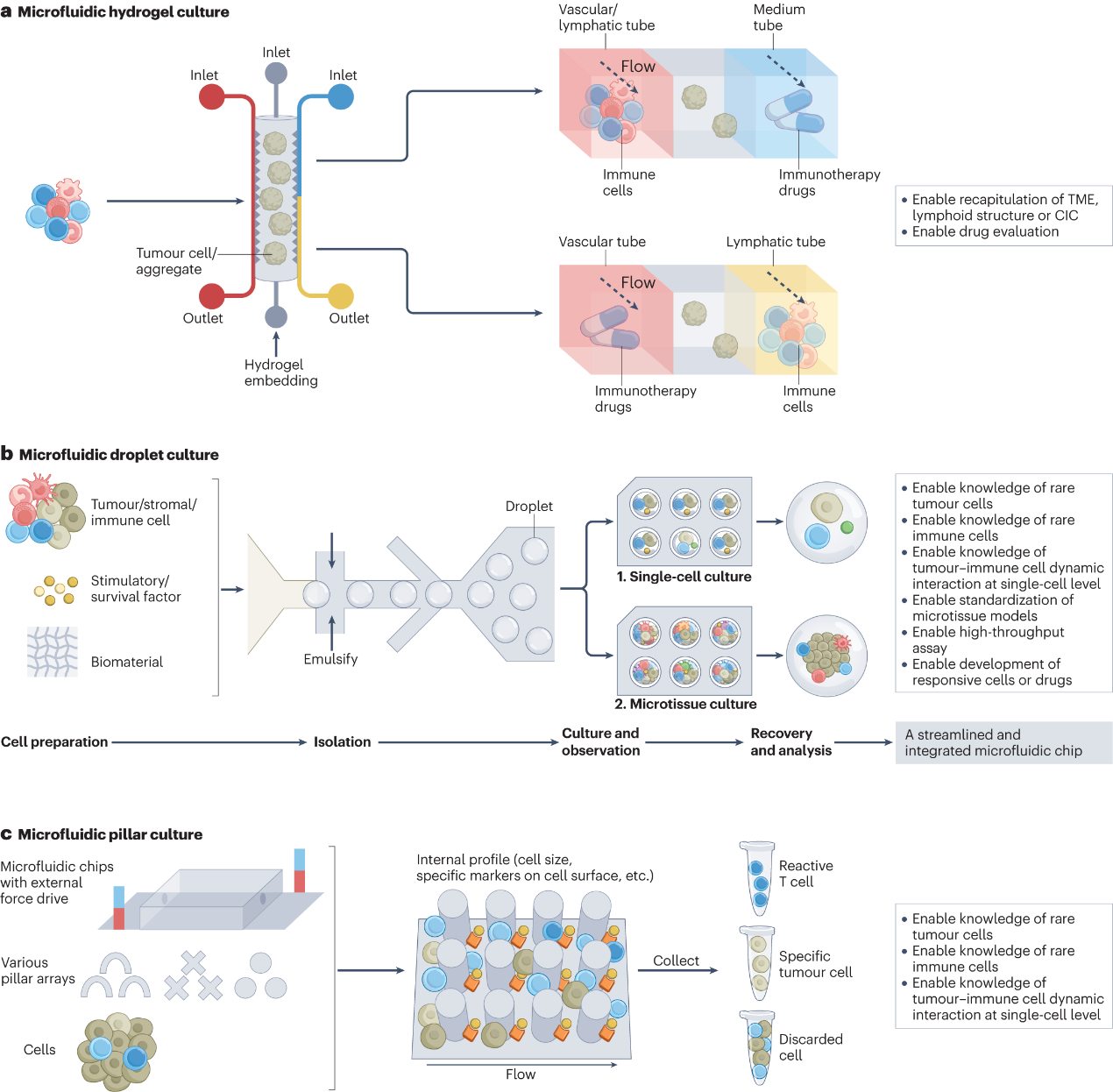
图3:用于肿瘤免疫学研究的微流控三维模型示意图
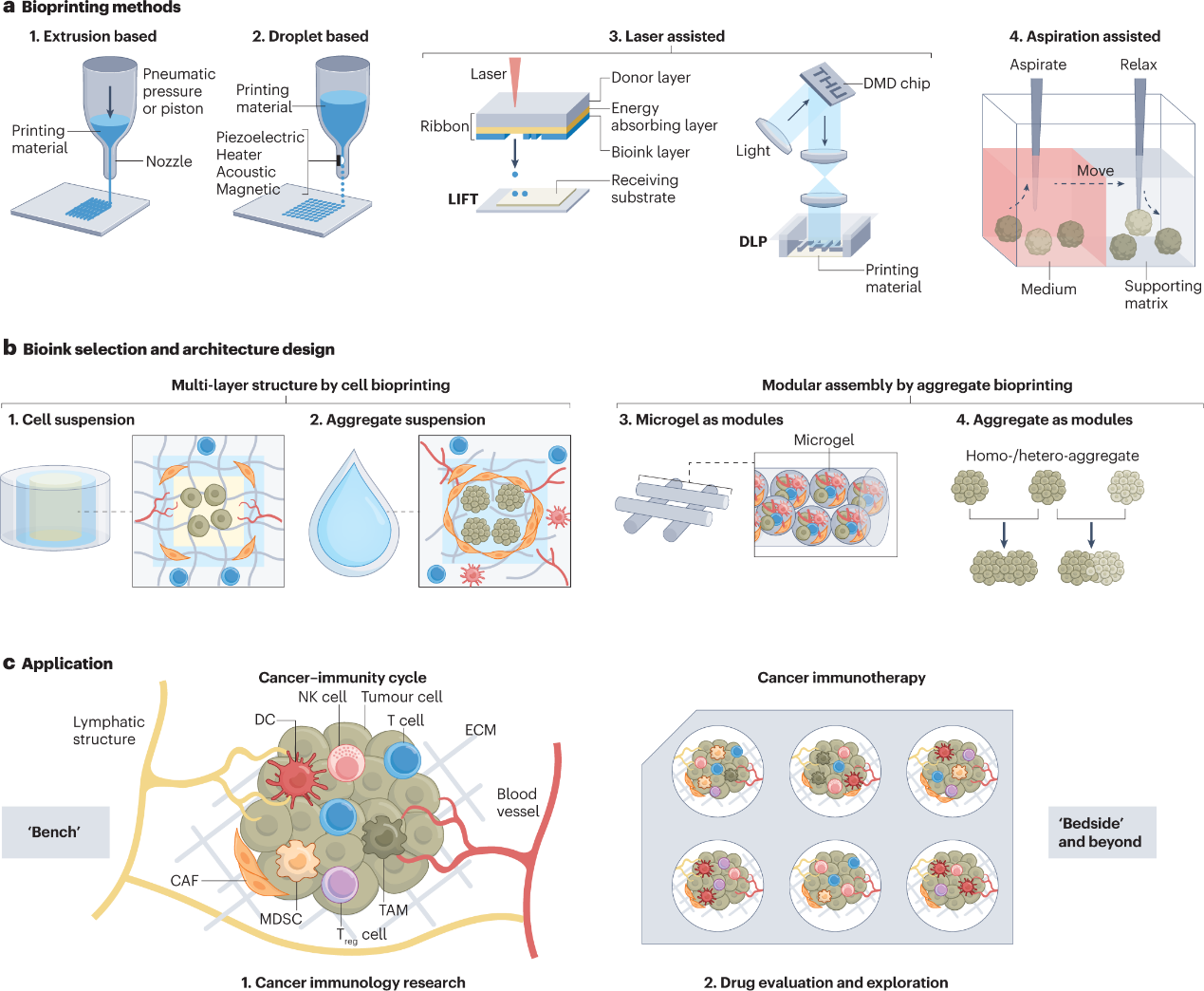
图4:用于肿瘤免疫学研究的基于生物打印的三维模型示意图
本研究团队全面回顾了各种体外三维建模技术,包括支架(图1)、类器官(图2)、微流控(图3)和三维生物打印(图4),并强调这些技术如何应用于模拟和再现CIC,评估免疫治疗策略,探索优化免疫治疗的方案及个性化的肿瘤免疫治疗。此外,评述和展望了该研究领域的挑战和重要发展机遇。
在过去的十年中,体外三维模型作为先进的生物模型被开发出来,以克服过度简化的二维细胞共培养和代表性差的人源化小鼠模型的缺点。由于这些体外三维模型可以纳入各种患者来源的细胞和基质,并允许时空安排,它们经常被用来模拟CIC中的各种免疫龛,特别是侧重于局部TME。这使得人们可以深入了解细胞-细胞和细胞-环境的相互作用。此外,三维模型生成的均匀性控制和高通量格式对于在临床前或临床药物评估中获得可靠的结果是有利的。特别是,随着对癌症免疫治疗的空前关注,越来越多的工作已经开始使用三维模型来重建癌症中的局部或全身免疫环境。最近的进展表明了体外三维肿瘤免疫学模型的潜在作用,包括在基础研究中更好地定义CIC,评估和探索免疫疗法,以及开发人工龛位辅助的“药物递送系统”(Drug Delivery System; DDS)。从而为在三维体外系统中解决实体瘤免疫治疗耐药或无效的问题(包括免疫抑制微环境、瘤体物理屏障、治疗性基因改造免疫细胞特异性过强、药物递送方案有限或不当)提供了前所未有的机会,为理解细胞和分子机制、提高免疫治疗效果提供了多维的资源。
近日,该工作以“利用三维体外系统建立实体瘤免疫反应模型:迈向改善和创造个性化免疫疗法的一步”(Harnessing 3D in vitro systems to model immune responses to solid tumours: a step towards improving and creating personalized immunotherapies)为题在线发表于国际顶刊杂志《自然∙免疫学综述》(Nature Reviews Immunology)上。清华大学机械工程系博士研究生周珍珍为文章第一作者,清华大学机械工程系生物制造团队庞媛副研究员和孙伟教授为文章的共同通讯作者。论文的重要合作者还包括博士生季静远、博士生何剑宇、博士后刘天坤、清华大学机械工程系欧阳礼亮副教授、国家癌症中心/中国医学科学院肿瘤医院张开泰教授和张文副研究员、上海交通大学医学院附属仁济医院上海市肿瘤研究所张志刚教授和张雪莉副研究员。该工作得到国家自然科学基金、国家重点研发计划、北京自然科学基金、北京科技新星计划、清华大学自主科研计划和111计划的支持。
论文链接:
https://www.nature.com/articles/s41577-023-00896-4