外周神经损伤(PNI)修复是神经外科领域的关键挑战之一,神经导管(NGC)作为潜在治疗方法正日益受到关注。然而,现有生物制造技术仍难以构建具有仿生理化微环境的神经导管,极大限制了实际治疗效果。为解决该难题,清华大学机械工程系生物制造中心孙伟课题组基于跨尺度纤维复合增材制造技术,开发了一种导电多尺度纤维神经导管(MF-NGC),为组织工程手段治疗周围神经损伤提供了一种新思路。相关成果近期以“3D Printed Conductive Multiscale Nerve Guidance Conduit with Hierarchical Fibers for Peripheral Nerve Regeneration”为题发表在综合类顶级期刊Advanced Science。
本文第一作者为清华大学机械系生物制造中心助理研究员方永聪,16级博士生王程锦(已毕业)为共同第一作者,通讯作者为清华大学机械系生物制造中心主任孙伟教授、熊卓副教授和张磊副研究员。清华大学机械系生物制造中心张婷副研究员及19级博士生刘子博、18级本科生高正训、20级本科生陈李等共同参与了本研究工作。该研究获得了国家自然科学基金联合基金重点资助项目(U21A20394),清华大学自主科研计划(20197050024),清华大学人才引进启动经费基金(53330200321),国家重点研发计划项目(2018YFA0703004)和中国博士后科学基金站前资助项目(2021TQ0184)等项目支持。
背景介绍
外周神经损伤是神经系统最常见的创伤性损伤之一,自体神经移植是治疗的金标准,但存在供体有限、供体功能丧失、神经瘤形成、神经扭曲或脱位、神经直径不匹配等问题。因此,近年来研究者致力于开发其替代品—神经导管(NGC),通过提供机械支撑和有利微环境来促进神经再生修复。现有研究表明,NGC中引入各向异性拓扑结构能够显著促进外周神经损伤的治疗效果。目前主要通过冷冻干燥、静电纺丝和3D打印等方法制备NGC,这些方法各有局限性,如冷冻干燥技术难以制备出复杂结构、规则孔隙的NGC,静电纺丝技术具有可重复性差、可定制性差等固有局限性,3D打印技术(主要是熔融沉积工艺,FDM)通常只能产生相对较大的纤维直径(>100μm),无法为轴突再生提供引导。近场静电直写技术(MEW)是熔体静电纺丝与3D打印相结合的一种新兴技术,可以实现亚微米纤维的精确定位,比常规3D打印技术小约2个数量级,在神经导管制备方面得到应用。另外,研究人员逐渐认识到NGC电活性对神经修复的重要性,并通过加入电活性材料(如碳纳米材料、导电聚合物)或表面涂层等技术来开发导电性NGC;然而导电材料的加入可能影响MEW打印能力。
基于此,清华大学机械工程系生物制造中心孙伟课题组研发了基于熔融沉积成型技术(FDM)、熔融近场直写技术(MEW)和静电纺丝的跨尺度3D打印成形平台,能够可控制备从纳米、微米到毫米级的多尺度纤维,同时提出一种导电多尺度纤维神经导管(MF-NGC),提供可与天然组织相媲美的多层级结构和力电性能,在外周神经修复方面具有“一石三鸟”之功效(如图1),体现在:1)在纳米尺度上,静电纺丝工艺制备的PCL/胶原(PCL/col)纳米纤维(直径~500nm))构成MF-NGC外层,具有良好的渗透性,在促进营养物质扩散同时阻碍成纤维细胞的浸润;2)在微观尺度上,采用MEW技术打印出直径~10µm的取向排列PCL微纤维,为神经再生提供引导;3)在介观尺度上,用MEW技术打印出直径~125µm的PCL/石墨烯(PCL/rGO)微纤维,提供了所需的机械稳定性和导电性能。
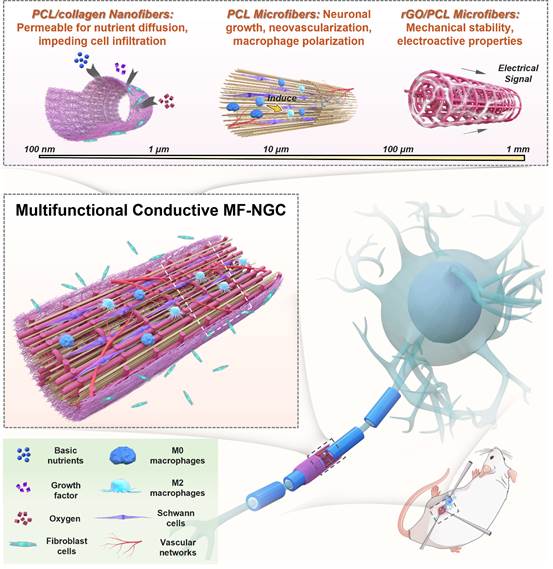
图1:导电多尺度纤维神经导管的设计示意图
实验结果
1.MF-NGC支架的制备与形貌表征
本研究提出的导电多尺度纤维神经导管制备过程如下:1)通过在旋转轴上依次打印PCL微纤维、PCL/rGO微纤维和PCL/col纳米纤维,制备中空神经导管;2)将PCL、PCL/rGO微纤维通过MEW打印成纤维片并卷曲填充到中空导管中构成MF-NGC。如图2所示,MF-NGC由直径500nm~125μm多尺度纤维组成,长度为15mm,外壁厚度为~500μm,打印成形使得其具有高度重复性的优势。SEM图像显示,MF-NGC内层由PCL微纤维和PCL/rGO导电微纤维密集填充。另外,外层含有随机纳米纤维和定向微纤维,模拟了天然神经外膜的结构特征,有利于功能神经的形成。

图2 MF-NGC支架的制备和形貌表征
2.MF-NGC支架的力学和电学性能评价
MH-NGC与MH-NGC在压缩测试中均表现出良好的压缩恢复能力和结构完整性,但MF-NGC的最大应力是MH-NGC的20倍(图3)。有限元分析表明,在5N的压力作用下,MF-NGC的形变显著小于MH-NGC,机械强度与较粗纤维(200μm)相当。同样,在拉伸测试中,MF-NGC应力在整个测试过程中显著高于MH-NGC。另外,MF-NGC断裂处伸长率超过100%,说明具有良好的回弹性。与MH-NGC相比,MF-NGC可以在更长的拉伸距离(~5mm)上承受更高的应力(~1.7N),并且在PCL中掺入(0.5mg )GO可以显著改善MF-NGC的力学性能,同时rGO/PCL的电导率显著高于纯PCL,这些结果表明MF-NGC满足所需的导电性能和机械稳定性要求。
)GO可以显著改善MF-NGC的力学性能,同时rGO/PCL的电导率显著高于纯PCL,这些结果表明MF-NGC满足所需的导电性能和机械稳定性要求。
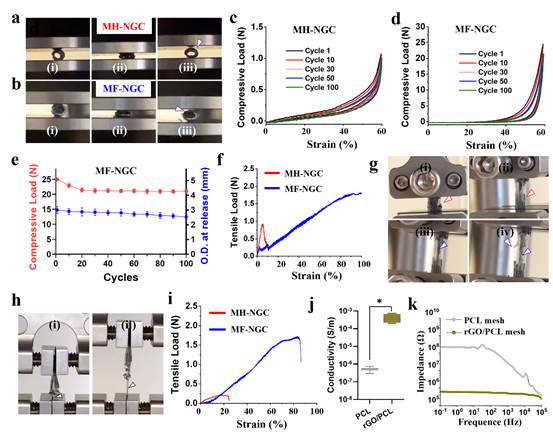
图3 MF-NGC支架的力学和电学性能评价
3.MF-NGC支架的体外生物学评价
雪旺细胞(SC)通过分泌神经营养分子促进外周神经轴突生长,因此,本研究将RSC96细胞种植到平面多尺度纤维支架,其由随机排列的纳米纤维和内部定向的微纤维组成(图4)。大部分SC在第1天呈不成熟的圆形形态,培养7天后SC增殖并覆盖整个支架,说明纤维支架能够促进SC增殖。第7天细胞骨架染色显示SC典型的纺锤状形态,同时SEM图像显示SC沿着定向微纤维生长,说明定向微纤维具有引导SC生长的作用。PC12细胞是一种具有与神经元相似特性的细胞模型,将PC12细胞种植在支架上可以观察到类似结果。另外,PC12细胞的轴突平均长度从第1天的9.6±2.7μm显著增加到第7天的42.5±12.8μm;同时,RSC96细胞定向比例(-10°~10°)大于80%,PC12细胞定向比例大于90%,表明多尺度纤维支架能够体外调控神经再生相关细胞的生长。
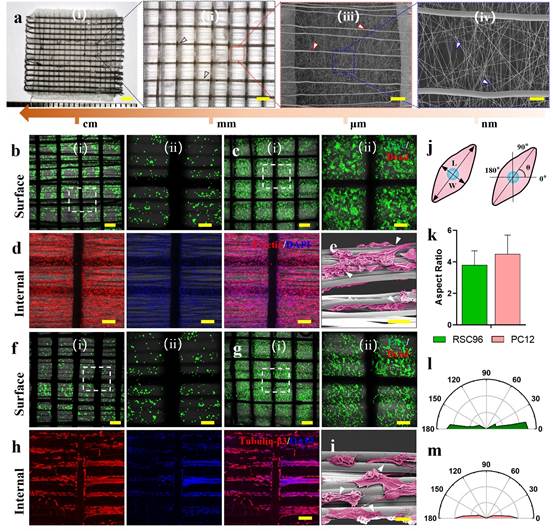
图4 MF-NGC支架的体外生物学评价
4.MF-NGC支架的体内神经修复评价
本研究制备长度为15mm的MH-NGC和MF-NGC,并分别植入到SD大鼠坐骨神经缺损部位,同时采用自体移植物作为阳性对照。术后4周后,神经组织再生延伸至所有导管且没有观察到纤维细胞的浸润;第4和8周MF-NGC中心区S-100和NF-200的阳性面积显著大于MH-NGC,与自体移植物组无显著差异。在血管化和免疫调控方面,第4周和8周的vWF染色结果显示MF-NGC中微血管密度显著高于MH-NGC,表明填充定向微纤维的神经导管支架可促进血管新生;第8周MF-NGC组M2/M1比值(4.8±1.5)显著高于MH-NGC组(1.8±0.7),表明其具有促巨噬细胞招募与向促再生M2表型转变的能力。在髓鞘形成方面,利用透射电镜分析髓鞘的厚度和数量,第4周MF-NGC组髓鞘厚度(522±85nm)显著高于MH-NGC组(409±62nm),与自体移植物组(544±75nm)相当;第8周各组髓鞘厚度均增加,MF-NGC的髓鞘数量(19±2个/FOV)显著多于MH-NGC组(9±2个/FOV)(如图5)。在腓肠肌恢复方面,第8周自体移植物组(57±5µm)和MF-NGC组(44±8µm)显著厚于MH-NGC组(19±6µm),且MF-NGC组胶原纤维面积(7.1%±4.0%)显著小于MH-NGC组(20.0%±3.0%),略高于自体移植物组(3.2%±1.6%),说明MF-NGC植入后可显著缓解轴突截断引起的肌肉萎缩。在腿部功能恢复方面,第4周MH-NGC组SFI(-77.4±4.2)低于自体移植组(-58.9±10.8)和MF-NGC组(-74.7±11.5),第8周MF-NGC组SFI(-51.5±8.6)显著高于MH-NGC组(-61.4.9±4.6)并与自体移植物组(-50.4±14.3)相当。综上,这些实验结果表明MF-NGC能够显著促进神经再生,达到与自体移植相当的水平。
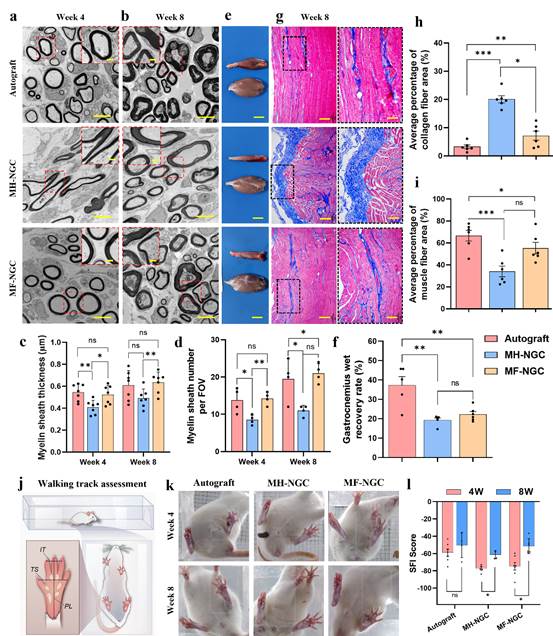
图5 坐骨神经再生修复评价
结论
本研究通过复合增材制造技术,设计开发了一种导电多尺度纤维神经导管,其表现出良好的纤维取向性、渗透性、导电性和机械稳定性,通过大鼠坐骨神经缺损模型发现其能够快速募集血管细胞和调节巨噬细胞向M2表型转变,显著促进外周神经再生、髓鞘形成和腓肠肌等功能恢复,为组织工程手段治疗周围神经损伤开辟了新的途径。
原文链接
Yongcong Fang, Wang Chengjin, Liu Zibo, et al. 3D Printed Conductive Multiscale Nerve Guidance Conduit with Hierarchical Fibers for Peripheral Nerve Regeneration. Advanced Science, 2023, 2205744.
https://doi.org/10.1002/advs.202205744