组织/器官的体外功能化重建是生物制造领域长期以来的努力目标;然而,组织器官的外部复杂结构和内部精细特征(如血管等)的耦合构建仍极具挑战。为解决该难题,清华大学熊卓、张婷课题组(BRE团队)提出了一种逐级悬浮3D打印技术(Sequential Printing in a Reversible Ink Template, 简称SPIRIT),相关成果近期以“Expanding Embedded 3D Bioprinting Capability for Engineering Complex Organs with Freeform Vascular Networks”为题发表在材料领域顶刊Advanced Materials上。利用前期工作中开发的兼具剪切稀化和自愈合特性的微凝胶双相(MB)生物墨水,SPIRIT技术通过将MB生物墨水在多级打印阶段分别用作可打印墨水和悬浮介质,成功构建了含可灌注血管网络的心室模型,这是现有生物3D打印技术所无法实现的。SPIRIT技术有效拓展了常规挤出3D打印的技术边界,能够实现具有复杂宏观结构和精细血管的组织器官快速构建,有望加速工程化组织器官在医学领域的转化应用。
本文第一作者为清华大学机械系生物制造中心方永聪助理研究员,通讯作者为清华大学机械系生物制造中心副主任熊卓副教授。清华大学机械系生物制造中心主任孙伟教授、张婷副研究员及硕士生郭依涵、博士生吴炳炎等共同参与了本研究工作。该研究获得了国家自然科学基金联合基金重点资助项目(U21A20394),清华大学人才引进启动经费基金(53330200321),国家重点研发计划项目(2018YFA0703004)和中国博士后科学基金站前资助 (2021TQ0184)等项目支持。
背景介绍
组织/器官的体外功能化重建是生物制造领域的难题之一,而生物3D打印技术凭借精确地逐层堆积生物材料的能力,引起了人们的极大兴趣。考虑到水凝胶的力学性能较差,悬浮生物3D打印技术受到了越来越多的关注。简单来说,悬浮介质具有独特的剪切稀化和自愈特性,在屈服应力下呈流态,在无应力下呈固态,能够支撑生物墨水的自由成形,而悬浮介质可以通过清洗或升温的方式被去除。例如,卡耐基梅隆大学的研究人员开发一种FRESH技术,可以将一个全尺寸的人类心脏模型悬浮打印到明胶微粒介质中。除了外部结构的复杂性外,构建功能化组织/器官的另一个障碍是缺乏分级血管网络,限制了氧和营养物质的传递。牺牲模板技术和多材料打印技术被广泛应用于在组织结构中构建复杂的血管网络,近年来,悬浮生物3D打印同样被用来打印具有更高仿生度的血管网络。具体来说,将牺牲性墨水悬浮打印至负载细胞的悬浮介质,打印后将牺牲墨水溶出得到中空通道。例如,哈佛大学研究人员提出的SWIFT技术通过,通过将明胶牺牲墨水悬浮打印至类器官悬浮介质中,去除明胶后得到可灌注的血管网络。总结而言,FRESH技术能够构建复杂外形,但很难成型血管网络等内部结构;SWIFT技术能够构建具有接近生理细胞密度的血管化组织,然而组织形状在很大程度上受到容器的限制,很难复现天然组织和器官的外部结构。
因此,亟需开发一种新的3D打印工艺,以实现复杂组织器官的外部几何特征和内部结构的耦合成形。为实现该目的,BRE团队提出了逐级悬浮生物3D打印技术(称为SPIRIT技术),至少包括i)在悬浮介质中打印生物墨水,得到组织和器官的复杂外部结构;iii)将牺牲墨水打印到初次打印但未交联的结构中,获得自由形态的血管网络;iii)原位交联,去除悬浮介质和牺牲墨水等步骤。SPIRIT技术的关键在于使用一种能够同时作为打印墨水和悬浮介质的生物材料,该团队采用了前期工作开发的载细胞微凝胶双相生物墨水,其在较宽的温度范围内表现出良好的剪切稀化、自愈合以及快速原位光交联能力,适合于SPIRIT打印技术。
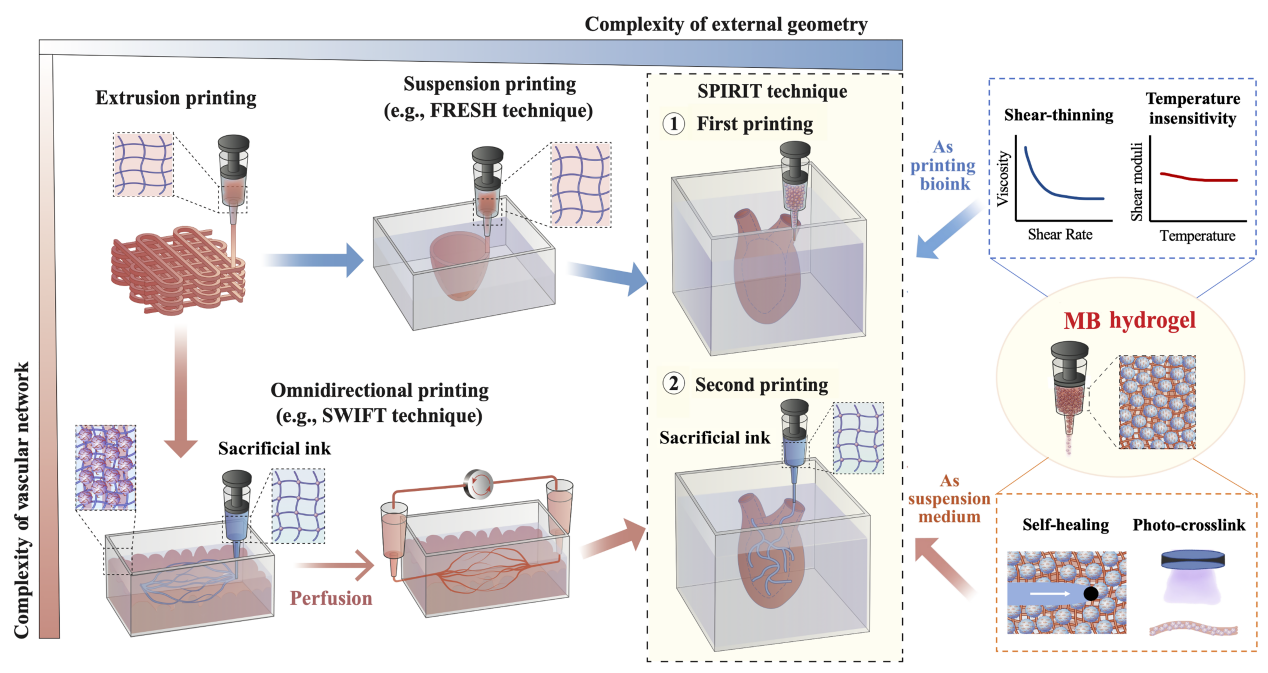
图1 逐级悬浮生物3D打印策略
实验过程
1.MB生物墨水的表征和打印
MB生物墨水由微凝胶和水凝胶前驱体组成,通过微流控法来制备(图2a),变异系数小于2.5%(图2b)。通过流道设计和流速调节,能够实现对微凝胶几何形状和大小的控制(图2c)。MB生物墨水表现出优异的打印性能,能够打印成各种结构(图2d-e)。负载hiPSCs的明胶/海藻酸盐微凝胶通过钙离子和微生物转谷氨酰胺(mTG)酶进行双交联,交联后的细胞活性处于中等水平(图2f)。将微凝胶与相同的水凝胶前驱体混合,得到MB生物墨水(图2g)。打印和交联后,hiPSCs的活力略有下降(图2h),表明打印过程对细胞活力有一定影响。在培养期间,hiPSCs继续增殖,并倾向于以胚状体(EB)的形式生长(图2i)。胚状体的直径随培养时间而增大(图2j),表明其具有较快的增殖速度(图2k)。第8天免疫荧光染色(图2l)和流式分析(图2m)证实hiPSCs能够保持较好的全能性(>80%)。在加入心肌细胞分化培养基后,hiPSCs开始向心肌细胞分化(图2n)。在分化14天后,观察到跳动的心脏类器官(图2o),证明载hiPSCs MB生物墨水可以通过原位增殖和分化来形成特定组织器官。
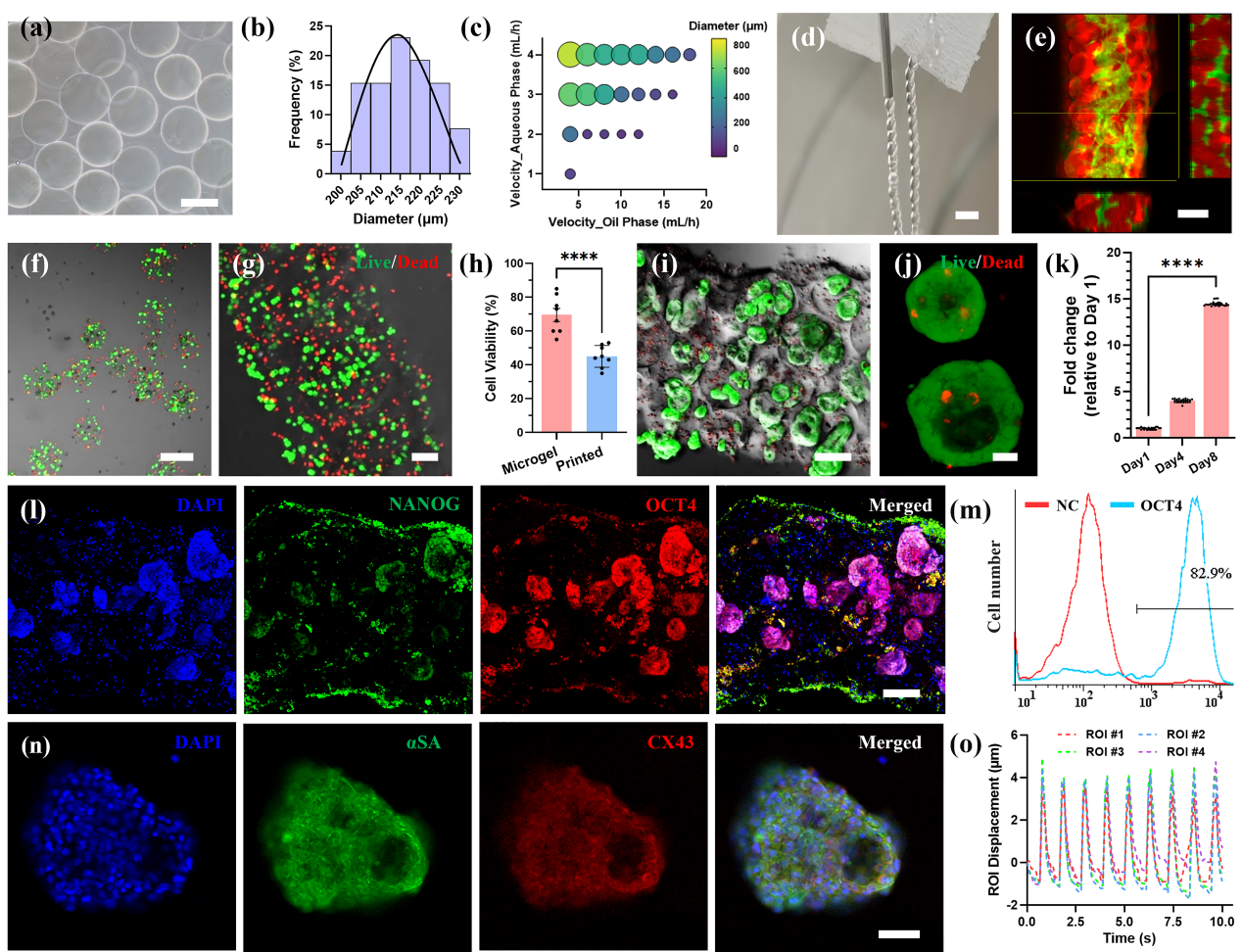
图2 载细胞MB生物墨水的表征和生物3D打印
2.MB生物墨水的悬浮打印构建复杂结构体
以锯齿形结构为例(图3a)进行悬浮打印工艺参数的优化,为定量比较打印结构和设计模型之间的差异,使用结构相似性指数(SSIM)来评估温度对打印精度的影响。首先,将打印结构的图像转换为二值图像,进行阈值分割,以确定平均丝宽和SSIM(图3b)。结果显示,提高打印温度会导致细丝加宽,在24 ℃时SSIM最高(图3c-d)。通过在恒定的打印速度下控制挤出速度,可以实时调节打印微丝的直径(图3e)。在Carbopol悬浮介质中打印了完整的心脏模型(图3f-g)、开放腔室(图3h-i)和支气管模型(图3j-k)。通过定量评估管状结构的形状保真度,进一步比较了直接打印和悬浮打印的打印精度(图3l-m)。光交联后将Carbopol悬浮介质去除,悬浮打印结构的外径和高度略高于模型设定值,而直接打印样本的尺寸略低于模型设定值(图3n)。这可能是因为在悬浮介质存在的情况下,细丝层间连接相对不那么紧密。
悬浮打印结构体可以承受反复的高应变拉伸(图3o-p),说明其具有优异的力学性能。进一步,分别对铸模和悬浮打印的实心圆柱体进行轴向压缩测试,获得应力-应变曲线,并计算弹性模量(图3q)。悬浮打印结构的弹性模量约为铸模结构的两倍(图3r),表明MB生物墨水的悬浮打印可以应用于软组织结构的制造。进一步,以HepG2细胞为例测试悬浮打印工艺对细胞活性的影响。通过Live/Dead染色来评估细胞活性,并以载HepG2的纯GelMA生物墨水作为对照(图3s-t)。载细胞微凝胶在3D纤维中分布均匀,细胞活性略低于对照组的细胞活性(图3u),可能原因包括MB生物墨水制备过程、Carbopol悬浮介质以及打印过程中的剪切应力;然而,悬浮打印结构中HepG2细胞在前5天表现出比对照组更快的生长速度(图3v)。
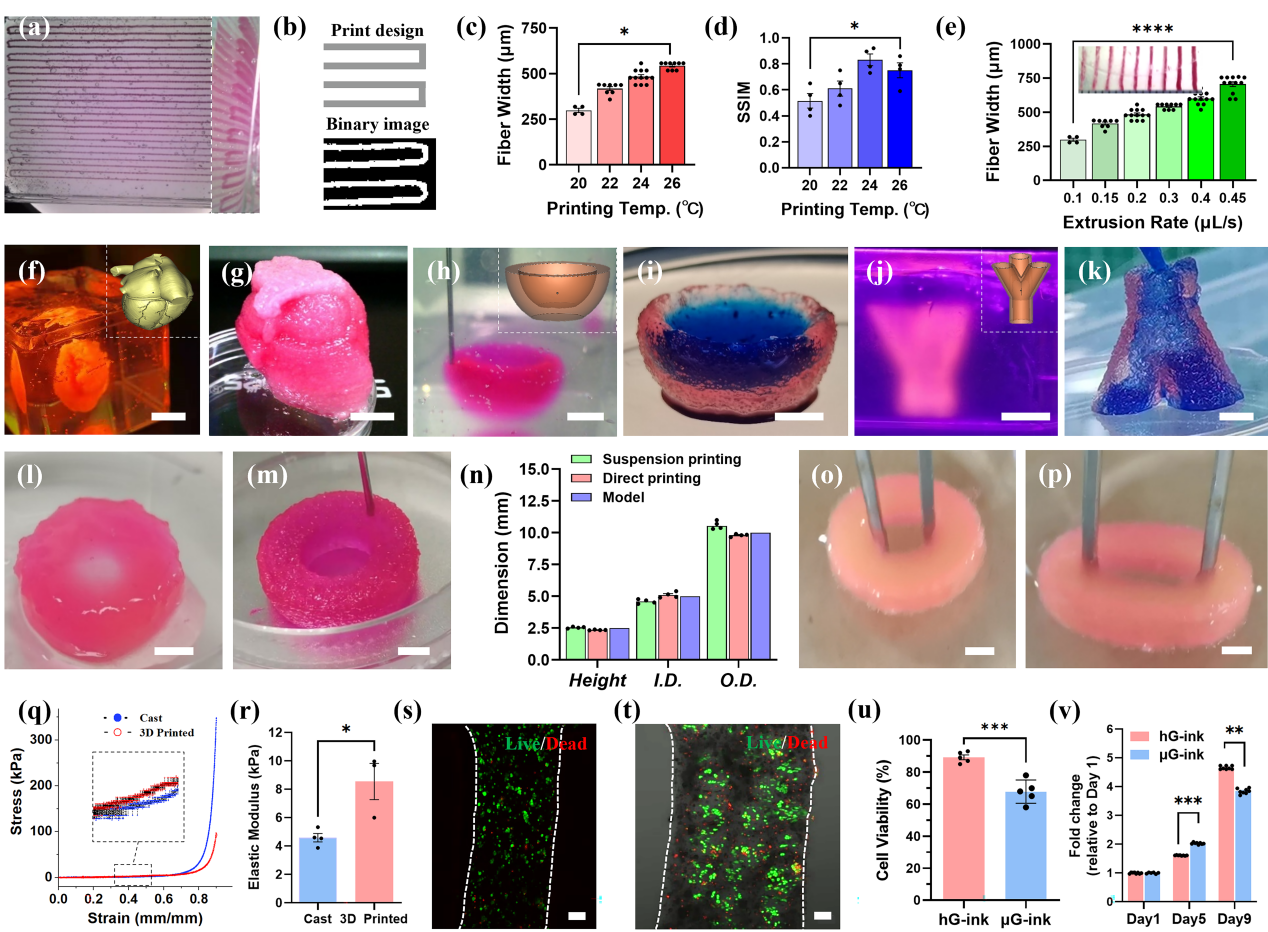
图3 悬浮打印MB生物墨水构建复杂结构体
3.以MB墨水为悬浮介质实现任意形状血管打印
为验证MB生物墨水作为悬浮介质的能力,将其转移到一个透明容器中,成功实现了牺牲性明胶墨水的悬浮打印(图4a)。打印的细丝在不同的挤出速度下呈不同直径,通过改变挤出速度,能够控制细丝宽度为250 μm到1000 μm(图4b-c)。MB生物墨水的流变性受温度影响较小,但打印保真度在一定程度上仍会受到温度变化的影响(图4d)。为实现以MB生物墨水为悬浮基质的打印,将MB生物墨水填充到特定形状的透明模具中,设计并打印了一条仿生的分叉通道(图4e)。打印后,进行光交联(图4f-g),将温度提高到37 ℃去除明胶,得到中空的通道。在通道中用蓝色墨水灌流,证明它们的可灌注性(图4h)。进一步制备载HepG2的MB生物墨水作为悬浮介质,在其中打印了可灌流通道,载HepG2的MB生物墨水的初始细胞活性为90%(图4i)。灌流培养18小时后观察,证明了通道灌流能够显著提高整个组织的细胞活性(图4j)。
进一步,使用载HUVEC的明胶墨水可以在结构体中形成内皮化通道,在第3天,观察到HUVECs均匀分布在通道中(图4k)。第7天,细胞增殖使得通道内形成一层均匀的内皮层(图4l),同时迁移到周围基质中(图4m)。此外,将红色MB生物墨水在透明MB生物墨水中悬浮打印网格结构,挤出保真度良好(图4n-o)。墨水和悬浮介质分别使用红色和绿色GelMA微凝胶,实现了打印墨水分布可视化(图4p)。这些结果都直接表明MB生物墨水既可以作为打印墨水,也可以用作悬浮介质。
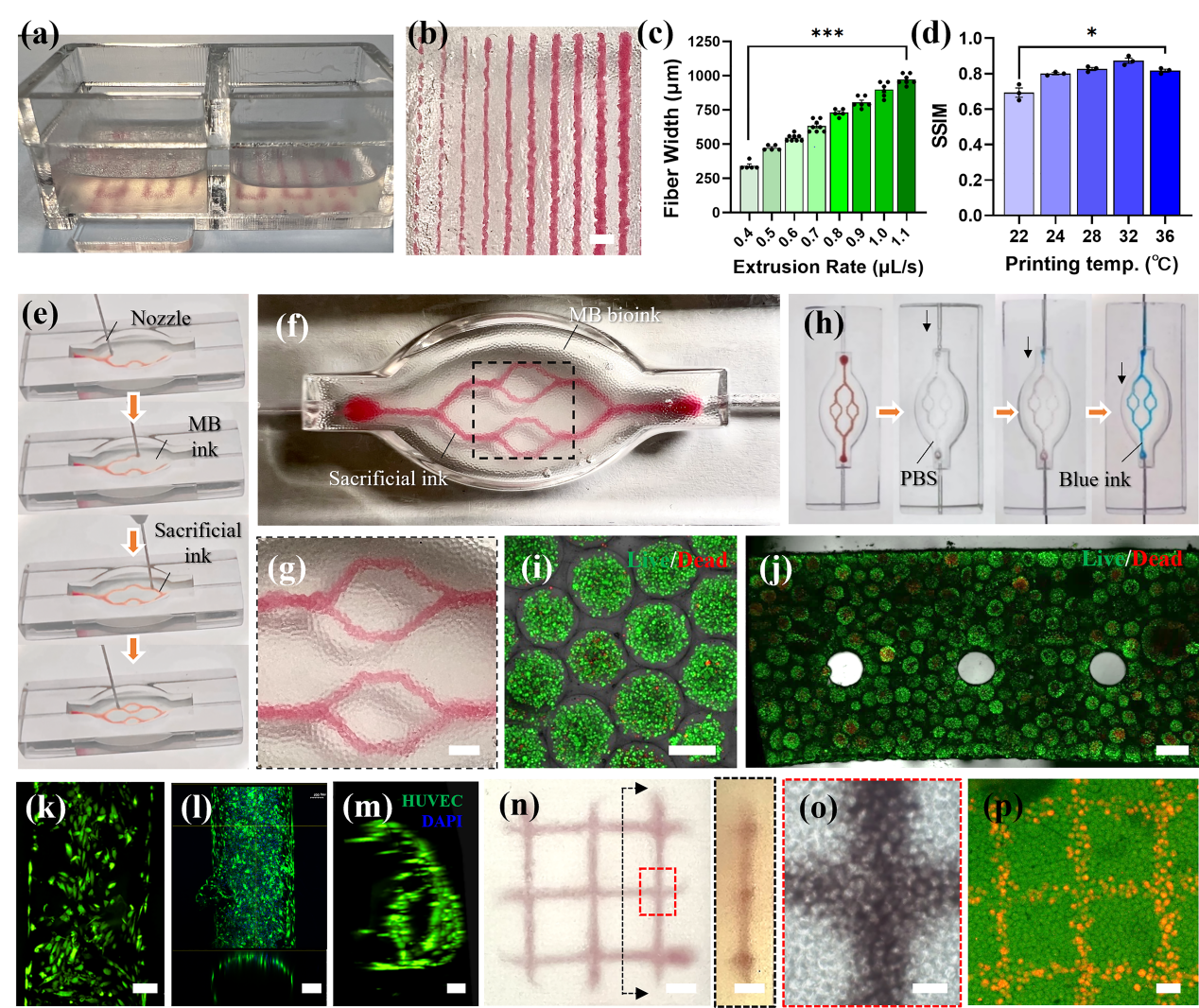
图4 MB生物墨水作为打印的悬浮介质
4.SPIRIT打印工艺
如前述,BRE团队开发了新型逐级悬浮打印(SPIRIT)技术,打印过程如下:(i)一级打印:将MB生物墨水打印到Carbopol或明胶微颗粒悬浮介质中,构建复杂的外部结构;(ii)二级打印打印:在一级打印完成后,将牺牲墨水打印到尚未交联的一级打印结构中,利用MB生物墨水的可逆自愈合性质来构建任意形状的血管网络;(iii)交联:通过原位光交联或温度交联,使打印的组织结构固化交联,同时保持步骤(i-ii)中打印结构的结构完整性;(iv)去除悬浮介质和牺牲墨水:通过温度变化或稀释等方式去除悬浮介质从而得到打印结构,而牺牲墨水可以同时或单独去除(图5a)。与现有3D打印技术相比,SPIRIT技术可以构造出具有复杂外部和内部精细结构的组织和器官。
为探究墨水浓度对打印性能的影响,分别制备了含5wt%和7.5wt% GelMA MB生物墨水,使用Carbopol悬浮介质和红色明胶来测试SPIRIT打印。在一级打印阶段,5%和7.5 % MB生物墨水在Carbopol悬浮介质中均顺利打印成中空管状结构;然而在二级打印阶段,针头在7.5 % MB生物墨水中会出现移动和旋转(图5c),而5 % MB生物墨水则不明显(图5d)。可能原因是7.5% MB生物墨水的剪切屈服应变远远高于悬浮介质,而5% MB生物墨水的剪切屈服应变则明显低于悬浮介质(图5e-f)。因此,采用5 % MB生物墨水打印了含螺旋细丝的管状结构(图5g-h),在去除悬浮介质和牺牲墨水后,成功用蓝色培养液进行灌流(图5i)。螺旋通道的尺寸接近设计值,表明SPIRIT打印具有良好的结构保真度(图5j);重复试验中结构尺寸都非常相似,证明了SPIRIT技术具有高度可重复性(图5k)。
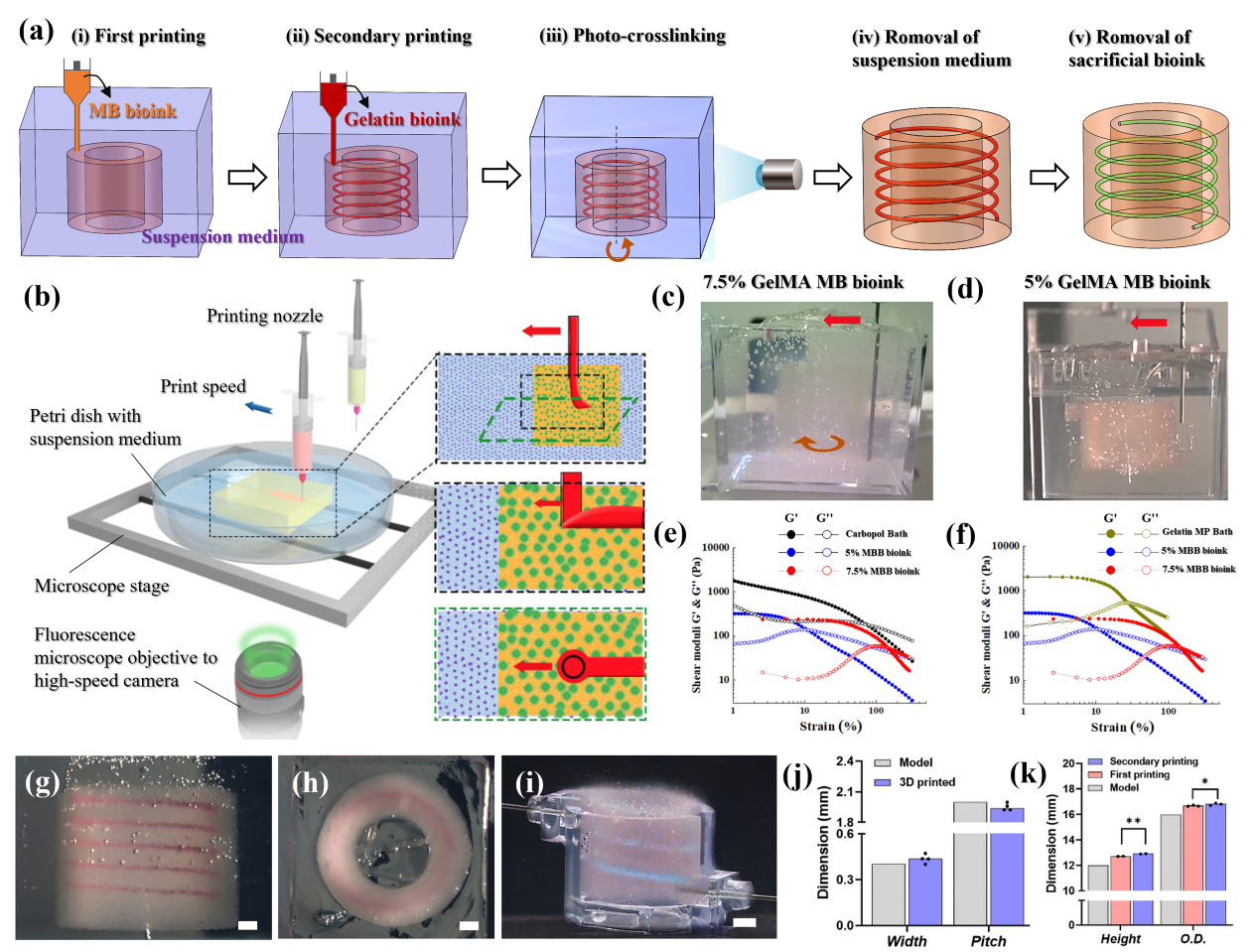
图5 基于MB生物墨水的SPIRIT工艺研究
5.SPIRIT打印含分级血管网络的心室结构
心脏是一个中空的腔室器官,具有非常密集的血管网络,然而现有生物3D打印技术尚无法构建兼具多腔室和血管网络的组织结构,因此本研究以血管化心室模型的打印来证明SPIRIT技术的打印能力。首先,创建了一个简化的心室模型,设计了一个位于心室模型中间表面的分级血管网络(图6a-b)。在使用MB生物墨水打印心室结构后(图6c),继续采用红色明胶墨水进行二级打印以创建血管网络(图6d-f)。在二级打印阶段,通过控制扫描次数或在恒定扫描速度下改变挤出速度来调节每个分支的直径,最终成功打印了具有分级血管网络的心室结构(图6g-h)。在去除悬浮介质和牺牲墨水之后,心室内分级血管网络可以进行反复的灌流(图6i-j)。为充分测试SPIRIT的打印能力,本研究设计了一种更复杂形状的血管网络。首先在二维平面设计了一个树枝状血管网络,进一步弯曲以形成类似于冠状动脉的血管网络(图6k)。氧传递的数值模拟结果显示致密的血管网络可以显著提高心肌腔室的氧供给效率(图6l)。利用SPIRIT工艺成功打印了一个具有变化直径的致密血管网络(图6m-n)。对打印结构进行微CT扫描,生成设计模型和打印结构之间偏差的云图(图6o),证明SPIRIT打印具有高形状保真度。需要注意的是,即使被打印喷嘴剪切了数百次,打印心室的几何形状仍然完好无损。
进一步评估打印心室的功能,采用新生大鼠心肌细胞(NRVCs)制备了MB生物墨水,并打印简化心室结构(图6p)。将打印的心室剪切成数片(图6q),并使用共聚焦成像来获得结构和细胞信息。Live/Dead染色表明,在体外培养过程中,打印的血管网络极大地促进了打印组织的活性(图6r-s)。第10天,打印的心肌组织发生同步收缩(图6f),免疫荧光染色证实了肌原纤维的形成和细胞的相互连接,表明打印心室的初步成熟(图6u)。这些结果证实了SPIRIT打印心肌组织具有正常功能,显示了SPIRIT技术在器官打印等医学应用中的应用前景。
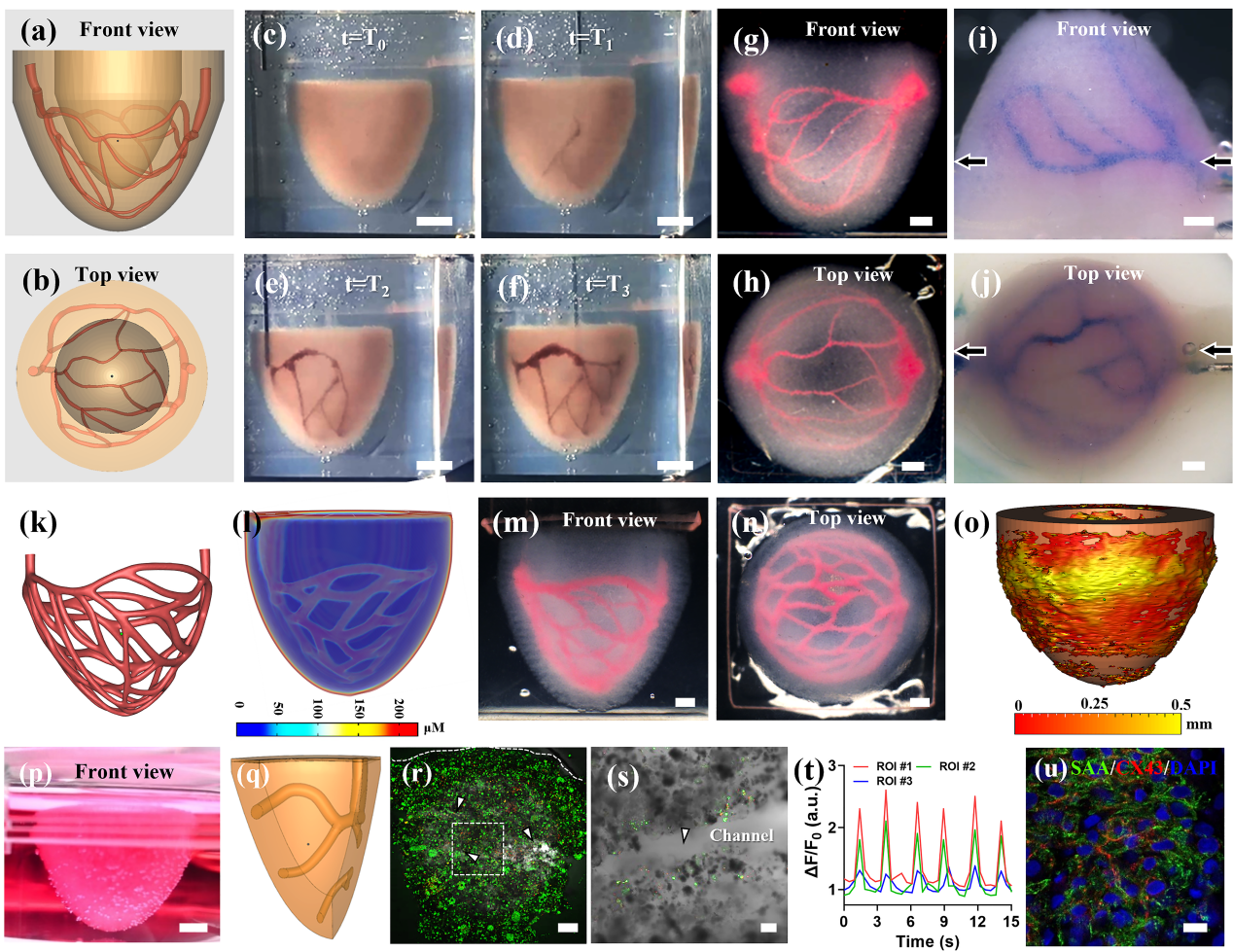
图6 SPIRIT打印含可灌注血管网络的腔室结构
结论
本研究开发了一种新型逐级悬浮生物3D打印(SPIRIT)技术,能够实现外部复杂结构和内部精细特征的耦合打印构建,并首次打印了一个具有复杂血管网络的心室结构,其具有良好的灌注性和收缩性能。此外,SPIRIT技术能够缩短打印时间,很好地兼容现有的悬浮介质和牺牲墨水体系,并可拓展到其他具有剪切稀化和自愈合特性的水凝胶墨水(如超分子水凝胶),为复杂组织/器官的体外功能重建提供了新的解决方案。
文章链接:
Fang Yongcong, Guo Yihan, Wu Bingyan, et al. Expanding Embedded 3D Bioprinting Capability for Engineering Complex Organs with Freeform Vascular Networks. Advanced Materials, 2023, 2205082.(doi: 10.1002/adma.202205082)